
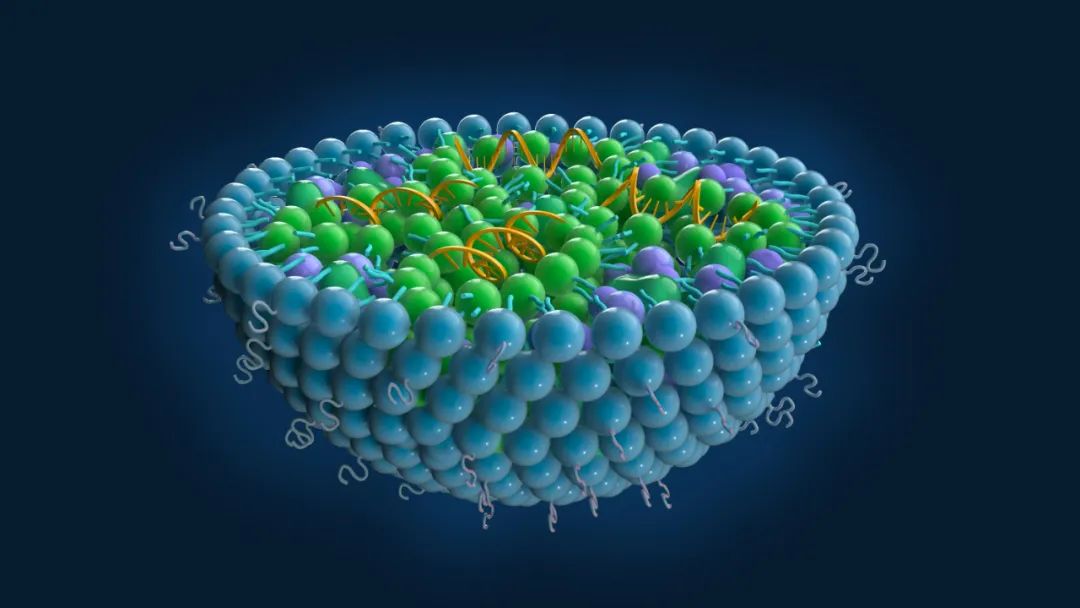
近日��,達(dá)晨投資企業(yè)、浙江海昶生物自主研發(fā)的新型冠狀病毒mRNA疫苗加強(qiáng)針項(xiàng)目(以下簡稱:HC009) IND申請獲得美國FDA批準(zhǔn) (IND:28424),是國內(nèi)首個被美國FDA批準(zhǔn)的mRNA疫苗項(xiàng)目。海昶生物的新冠mRNA疫苗加強(qiáng)針產(chǎn)品將用于預(yù)防包括奧密克戎在內(nèi)的多種變異株感染�����,適用于已接種新冠疫苗的人群以及空白人群。HC009采用海昶生物具有全球自主知識產(chǎn)權(quán)的QTsomeTM作為遞送系統(tǒng)�,在產(chǎn)業(yè)鏈合作伙伴們的助力下,共同打造全球領(lǐng)先的mRNA疫苗產(chǎn)業(yè)化平臺����。
新冠mRNA疫苗屬于核酸藥物這一細(xì)分賽道�����。傳統(tǒng)生物制藥工業(yè)先后經(jīng)歷了小分子藥物和蛋白類藥物兩大浪潮��,但二者的研發(fā)均受到“靶點(diǎn)成藥性”的限制�。而核酸藥物則是以核酸為靶標(biāo)�����,通過對蛋白翻譯過程的調(diào)控來實(shí)現(xiàn)疾病治療���,具有靶點(diǎn)豐富�����、研發(fā)周期短��、藥效持久�����、臨床開發(fā)成功率高等優(yōu)勢�����。經(jīng)過四十余年的研究積淀���,核酸藥物在化學(xué)修飾�、藥物遞送方面不斷取得進(jìn)展��。特別是疫情期間�,新冠mRNA疫苗在研發(fā)效率和藥物療效方面所展現(xiàn)的優(yōu)勢讓產(chǎn)業(yè)界和投資界看到了核酸藥物的巨大潛力�����。未來��,具備平臺屬性的小核酸藥物的治療領(lǐng)域?qū)⒉粩嗤卣梗?/span>核酸藥物有望引領(lǐng)第三次現(xiàn)代制藥的浪潮�����,海昶生物即是當(dāng)中的代表企業(yè)之一。海昶生物總裁趙孝斌博士表示:“新冠病毒的快速變異對疫苗研發(fā)帶來巨大挑戰(zhàn)����。mRNA疫苗有靶向精準(zhǔn)、設(shè)計簡便����、免疫保護(hù)持久等優(yōu)勢,是預(yù)防突破性感染的有效手段之一��。我們將加快推進(jìn)海內(nèi)外臨床試驗(yàn)布局����,以期待為應(yīng)對疫情變化提供更有效的武器。我們不斷拓展mRNA技術(shù)平臺建設(shè)���,發(fā)揮QTsomeTM遞送系統(tǒng)的優(yōu)勢����,加強(qiáng)其他預(yù)防性疫苗���、腫瘤疫苗等創(chuàng)新品種的開發(fā)��?!?/span>






 微信公眾號
微信公眾號